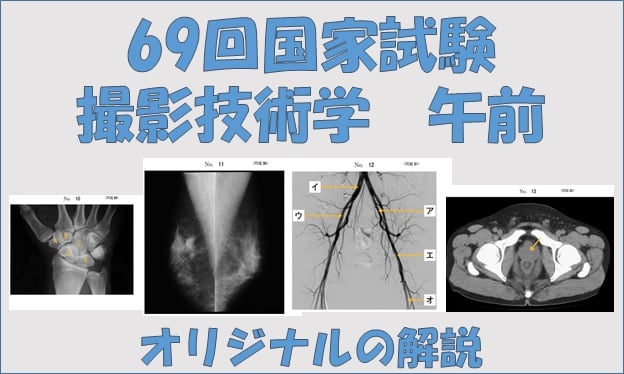
毎年のように出題されるIVR画像。対策をしていないと、見慣れないため解答時に悩むことが多いように感じます。特にIVR画像は、DSA画像、つまり骨が無い画像のことが多く、血管だけの画像が出題されることになります。 といっても、明らかに出題される頻度が高いのが、頭部血管と出血病変に対する止血処置画像といったものです。なので、その辺を中心にまとめてみたいと思います。
理系の分野は、単位が少し違うだけで、呼び名が変わります。その一つに含まれるのが、LETです。 では、LETとはなんなのか?どういった作用に使われるのか?まとめてみたいと思います。 スポンサーリンク LETとは? LETとは、Linear enetgy transfer:線エネルギー付与の略です。 これは、単位距離を通過するときにどれだけのエネルギーを与えるかを表します。放射線に関わる単位の中には、他に単位時間あたりの線量を表す線量率がありますが、まったく異なるものです。線量率の単位はGy/minなど、秒を表す(s)や分を表す(min)などが分母に使用されていました。
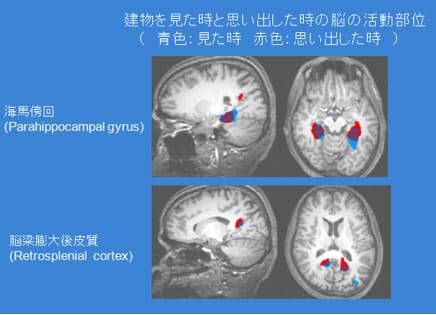
最近、MRI専門の書物をはじめ、新聞や雑誌でもf-MRIという単語を見かける機会が多くなっているように感じます。 そのためか、f-MRIは脳機能を画像化することができるということを知っている方は多いのではないでしょうか。 しかし、どうやったら脳機能をMRIで画像化しているのか? なぜ、脳機能を知ることが出来るのか?
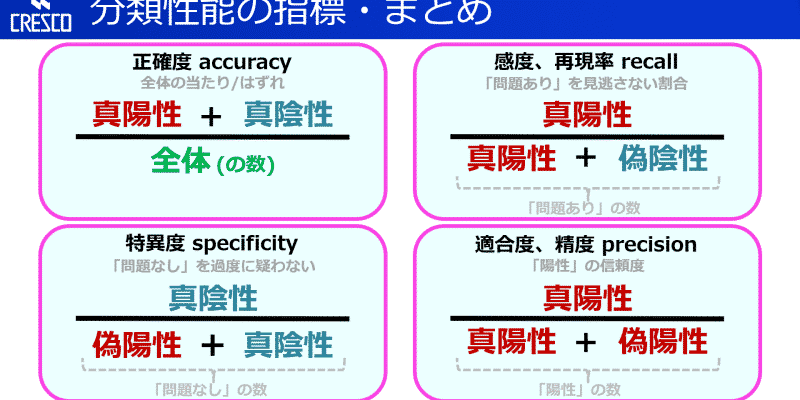
から、まとめてみたいと思います!!検査の信頼性を示す指標として用いられるのが、感度と特異度です。感度が低ければ病気を発見できないし、特異度が高ければ病気がないのに間違えて陽性と判断することがない(誤診や見落としと言われることも)と言えたりと、とにかく頭の中でごちゃごちゃしやすいです。 ということで、どう計算されて、なにを表しているのか一つずつ見ていきます。
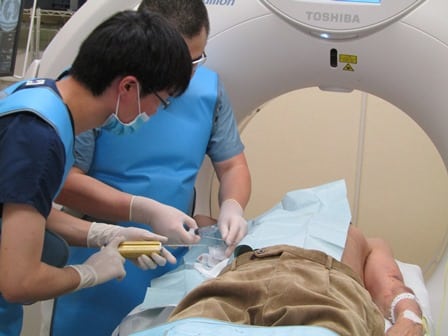
CTとMRIなど画像検査を行った結果として病気が見つかった場合、その病気が悪性で治療が必要なのか良性で治療の必要がないものか判断できない場合があります。 その場合、病気の一部を実際に採取し、細胞を調べる生検なる検査が行われ、確定した診断を得ることになります。 ただ、その病気の一部を取るためには、内視鏡や手術のような外科的、もしくは体外から針を刺す(穿刺)が必要です。
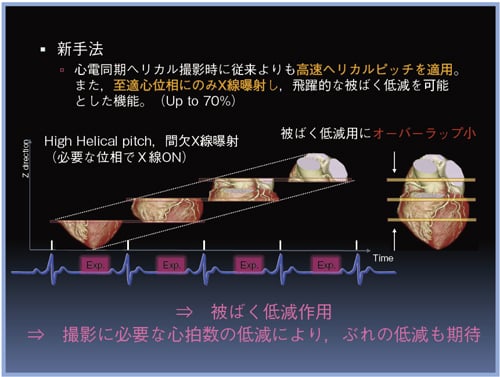
心臓は、全身に血液を送りこむという臓器の中でも特に重要な役割を果たしている臓器です。当然ですが、その動きが止まるということは、生命の危機ともいえるような状況です。 よって、心臓に病気が何か疑われる状況なので、一時的に心臓を止めて検査しようかなんてことは現実的でないというより、不可能なことです。しかし、CT検査では、動きというのは、ボケやアーチファクトに影響し、画質を劣化させ、診断能を低下させる最大要因の一つなのです。
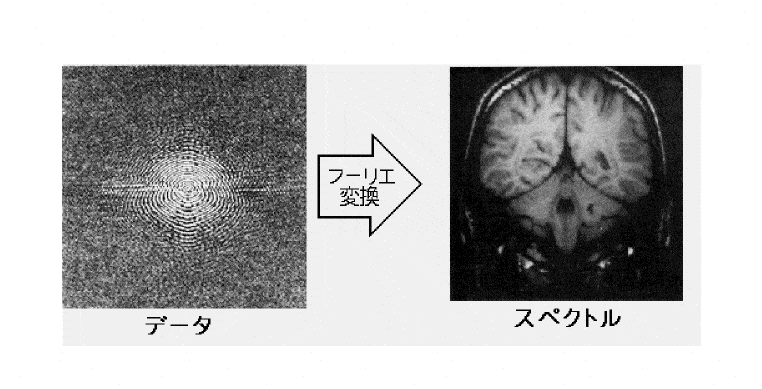
以前にまとめたk空間とはに続き、画像との関係性についてもまとめてみたいと思います。 k空間が画像にどう影響し、k空間からどうやって画像が作られているのか理解の助けになれば幸いです。 スポンサーリンク k空間と画像の関係とは? ここまでは、k空間がどういったもので、どういうルールがあるのかということをまとめて来ました。
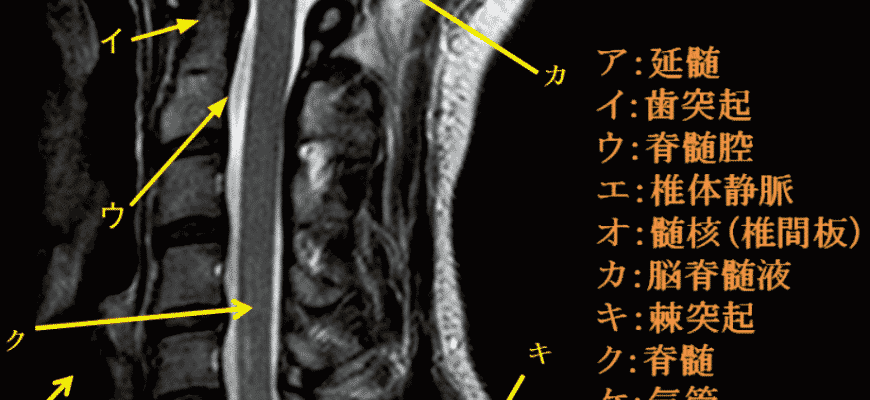
脳梗塞の診断をはじめとする、頭部MRI検査の需要が高まっており、今では欠かせないものとなっています。それに伴い、国家試験でも頭部MRIに関する問題が多く見られます。 なので、画像解剖を始め、代表的な疾患くらいはわかるようにしておいたほうがいいでしょう。診療放射線技師国家試験問題を元にまとめてみました。
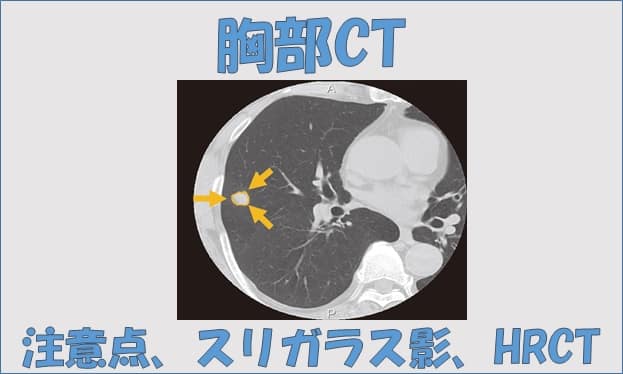
CT画像を観察するうえで、画質とはとても重要です。その中でも、モノを見分ける力、分解能は特に重要といえるでしょう。 分解能が高ければ、正常と異常を区別することが容易になりますし、分解能が低ければ、正常と異常を見分けることが困難になります。ただ、分解能にも、高コントラスト分解能と低コントラスト分解、さらには、時間分解能という概念があります。
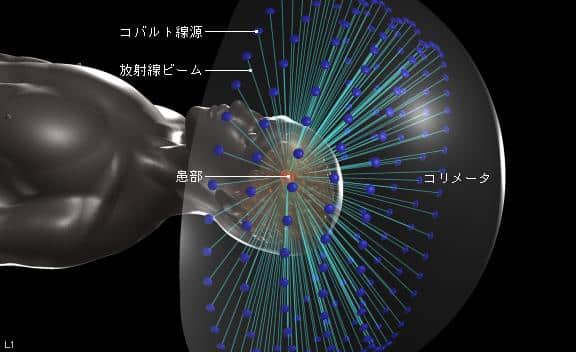
確かに、放射線はガンの治療に使用されることもありますが、大半の方の認識としては身体にとって毒なものだということです。 実際、放射線は身体に害をなすものなので、がん治療時であろうとがん以外の正常な組織への放射線被ばくは大きな問題となります。その問題に対応し、かつ、より良い治療を行う方法の一つが定位放射線治療です。